Les principales étapes de la reproduction
I. le travail de reproduction chez chacun des sexes
a. les déterminismes internes - la capacité interne des organes au travail de reproduction
1. au niveau de l'organisme entier :
L'apparition de la puberté est sous la dépendance de facteurs internes mais aussi de l'alimentation. On rapporte par exemple comme un fait clairement établi que l'âge des premières menstruations pour les filles européennes est tombé de 15-16 ans en moyenne en 1900, à 12-13 ans dans les années 70 ; tout en précisant qu'en 1900 les jeunes filles de milieux aisés avaient leurs premières règles à l'âge de 12-13 ans. Une chose est certaine : l'âge moyen cache une grande variabilité individuelle.
Les phénomènes de vieillissement touchent aussi bien les ovaires (épuisement du stock d'ovocytes à partir de 38-40 ans), que l'utérus (ralentissement de la préparation cyclique à la gestation, augmentation de la mortalité embryonnaire et des avortements) et les mécanismes physiologiques régulateurs (cycles ovariens anormaux.., chute des taux hormonaux à la ménopause).
Pour les garçons, la puberté est plus tardive.
2. au niveau des organes:
2.1 Chez la jeune femme
Les organes de la reproduction, c'est-à-dire impliqués de façon directe et nécessaire dans le travail de reproduction sont:
- les voies génitales : un vagin (impair), avec les structures annexes correspondant à la partie la plus externe du tractus génital : la vulve (fermée partiellement par l'hymen), le périnée, les grandes et les petites lèvres, le clitoris): l'organe de l'accouplement, l'utérus (impair mais terminé par deux cornes utérines paires) : l'organe de la nidation et de la gestation, les oviductes ou trompes de Faloppe (pairs et terminés chacun par un pavillon) : organes de la fécondation
- les glandes génitales : les ovaires : organes de la gamétogénèse (production des gamètes), les mamelles (seins) : organes de la lactation, des glandes annexes associées aux voies génitales : les glandes de Bartholin.
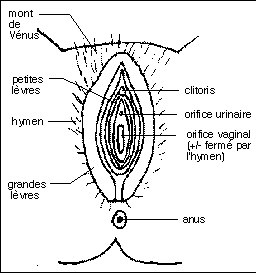
Les organes génitaux externes (vulve) de la femme.
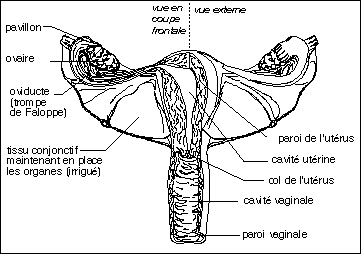
Les voies génitales féminines en coupe frontale (partie gauche) et en vue externe (partie droite).
Les glandes de Bartholin débouchent à l'extrémité vaginale, avant le repli des petites lèvres, non représenté ici.
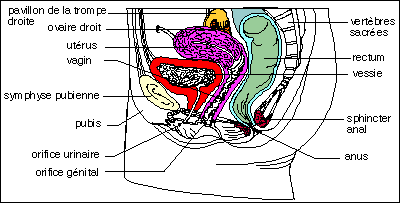
Coupe sagittale du bassin féminin très schématique. Vous noterez la position de l'utérus, col orienté vers l'arrière, et des ovaires latéraux, coiffés par les pavillons dans leur partie antérieure.
Un peu d'embryologie pour ceux qui veulent approfondir:
Les ovaires (gonades femelles) se mettent en place chez le fœtus humain entre la 4ème et la 7ème semaine de vie fœtale (le fœtus mesure entre 6 et 8 mm) à partir des crêtes génitales situées au sommet des lames latérales qui sont des massifs de tissus embryonnaires qui font partie du mésoderme (tissu en position intermédiaire entre le feuillet externe : l'ectoderme et le feuillet interne : l'endoderme) au stade bourgeon caudal. Les ébauches gonadiques sont colonisées par des cellules germinales d'origine variées selon les classes de Vertébrés. Les cellules somatiques (par opposition à germinales) forment un blastème (amas de cellules embryonnaires) d'origine discutée selon les groupes de vertébrés. Les premiers follicules ovariens n'apparaissent que vers la 16ème semaine de gestation (le fœtus mesure alors une dizaine de centimètres de long). La différenciation du tractus génital femelle commence vers la 8ème semaine de vie fœtale ( le fœtus mesurant alors quelques 3-4 cm), à partir des pièces intermédiaires, issues des mêmes massifs mésodermiques que ceux donnant les ovaires. Les canaux de Müller embryonnaires donneront l'oviducte et l'utérus, la vagin résulte de l'évolution de la zone de jonction (sinus) entre les canaux de Müller et de Wolff (ces derniers régressant dans le sexe femelle), les bourrelets génitaux ectodermiques donneront les lèvres, et le tubercule génital, qui donne ici le clitoris et le pénis chez l'homme. En absence de stimulation par les hormones mâles (testostérone produite par les cellules de Leydig dès la 8ème semaine de vie fœtale) et hormone antimüllerienne (AMH), possible jusqu'à la 16ème semaine, les organes génitaux évoluent naturellement en organes femelles. Si le rôle d'un facteur contrôlé par le chromosome Y (TDF, Testis Determining Factor) semble avoir été mis en évidence, il n'en reste pas moins que le contrôle de la différenciation sexuelle reste largement inconnu. On ne connaît pas la liaison précise entre le sexe chromosomique (cytogénétique) et le sexe histologique et physiologique.
|
L'ovaire assure 4 fonctions : |
Les ovaires sont irrigués par une artère qui pénètre entre les follicules et se ramifie. Mais les capillaires ne dépassent pas la lame basale des follicules. De nombreuses expériences de greffe ont permis de mettre en évidence la sécrétion par les follicules en croissance de nombreux facteurs chimiques (VEGF, TGFalpha...) qui stimulent la multiplication et la croissance des cellules endothéliales et donc favorisent la revascularisation des ovaires greffés.
L'innervation ovarienne (essentiellement sympathique) se développe en même temps que la vascularisation et les cordons nerveux suivent les vaisseaux sanguins (dont elles innervent les fibres lisses) jusqu'aux cellules de la thèque externe des follicules. De nombreux neuromédiateurs ont été isolés de l'ovaire (NAdr, dopamine, substance P, VIP, NO...) et interviennent soit dans l'expulsion des ovocytes, soit dans le débit sanguin et donc, indirectement, dans la croissance des follicules.
L'ovulation est un phénomène rapide (quelques minutes) et libère habituellement un ovocyte secondaire de façon alternée entre l'ovaire droit et gauche chez la femme (le taux d'ovulation , nombre d'ovocytes libérés en même temps est habituellement de 1 chez la vache, 2 chez la brebis, 8 à 30 chez la truie et 6 à 17 chez la ratte). La libération simultanée de deux ovocytes par l'un ou les deux ovaires chez la femme peut conduire à la gestation de (faux) jumeaux. L'ovulation est "spontanée" chez la femme dans le sens où elle ne semble pas être habituellement "provoquée" comme c'est le cas par exemple chez la chatte (la lapine, la femelle du vison, de l'écureuil...) à la suite d'une stimulation lors de l'accouplement. Mais il est connu qu'un stress, un accident, une émotion... peuvent provoquer l'ovulation chez la femme. Il semble que l'ovaire présente des contractions musculaires qui assurent l'expulsion de l'ovocyte secondaire entouré de ses cellules folliculaires formant le cumulus oophorus et accompagné du liquide folliculaire (liquor folliculi), lors de la rupture du follicule mûr (follicule de De Graaf) qui fait saillie à la surface de l'ovaire (son diamètre atteint 2 cm pour un ovaire d'un diamètre maximal de 3 cm). La commande de ces contractions pourrait être d'origine nerveuse mais aussi simplement causée par la baisse de pression dans la cavité folliculaire (voir plus bas). L'ovulation s'accompagne parfois de légers saignements. Après l'ovulation le follicule rompu se referme et se transforme en corps jaune par une croissance des vaisseaux sanguins qui colonisent la granulosa dans laquelle les cellules folliculaires se transforment en cellules lutéales sécrétrices (luteus = jaune en latin). Un caillot sanguin persiste au centre du corps jaune. Le corps jaune se forme en quelques heures, fonctionne une quinzaine de jours puis régresse rapidement en absence de fécondation (corps jaune cyclique ou provisoire), il perd sa couleur et se transforme en masse fibreuse, le corps blanc, qui disparaîtra, ne laissant la place qu'à une cicatrice à la surface de l'ovaire. En cas de fécondation le corps jaune se développe et devient corps jaune gestatif qui persiste pendant presque toute la durée de la grossesse. Le cycle ovarien est donc long (5 mois minimum, l'ovulation intervenant au début de la dernière quinzaine), alterné et chevauchant (entre les deux ovaires, séparé par 28 jours en moyenne de décalage, ce qui permet un fonctionnement cyclique avec une ovulation chez une femme tous les 28 jours). On a l'habitude de parler d'un cycle sexuel de 28 jours mais c'est celui de l'utérus qui commande l'événement le plus marquant : l'apparition des règles qui revient effectivement tous les 28 jours en moyenne (cette durée varie selon les femmes et au cours de leur vie ; on a observé que les cycles les plus longs correspondent aux femmes les plus jeunes (entre 25 et 43 jours entre 13 et 17 ans) et les cycles les plus courts aux femmes les plus âgées (entre 24 et 32 jours à partir de 40 ans). Ainsi la phase préovulatoire est appelée phase folliculaire et dure pas en fait 14 jours mais plus de 4 mois et demi pendant laquelle de nombreux follicules commencent une maturation. Par contre la phase post-ovulatoire ou lutéale ou encore lutéinique, dure effectivement environ 13-14 jours si l'on considère uniquement la période de fonctionnement du corps jaune.
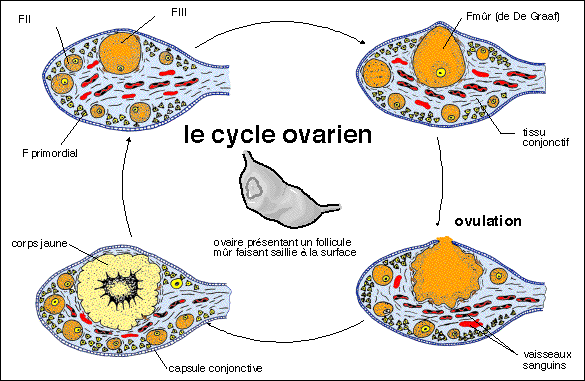
Le cycle ovarien pour un ovaire chevauche celui d'un autre ovaire et correspond non pas à l'évolution d'un seul follicule comme on peut le supposer à partir de ce schéma mais de plusieurs centaines de follicules primordiaux (600 ?) qui donneront au plus 1 unique follicule mûr ovulant (sauf dans certains cas d'obtention de jumeaux) puis un corps jaune qui finit par devenir follicule blanc cicatriciel.
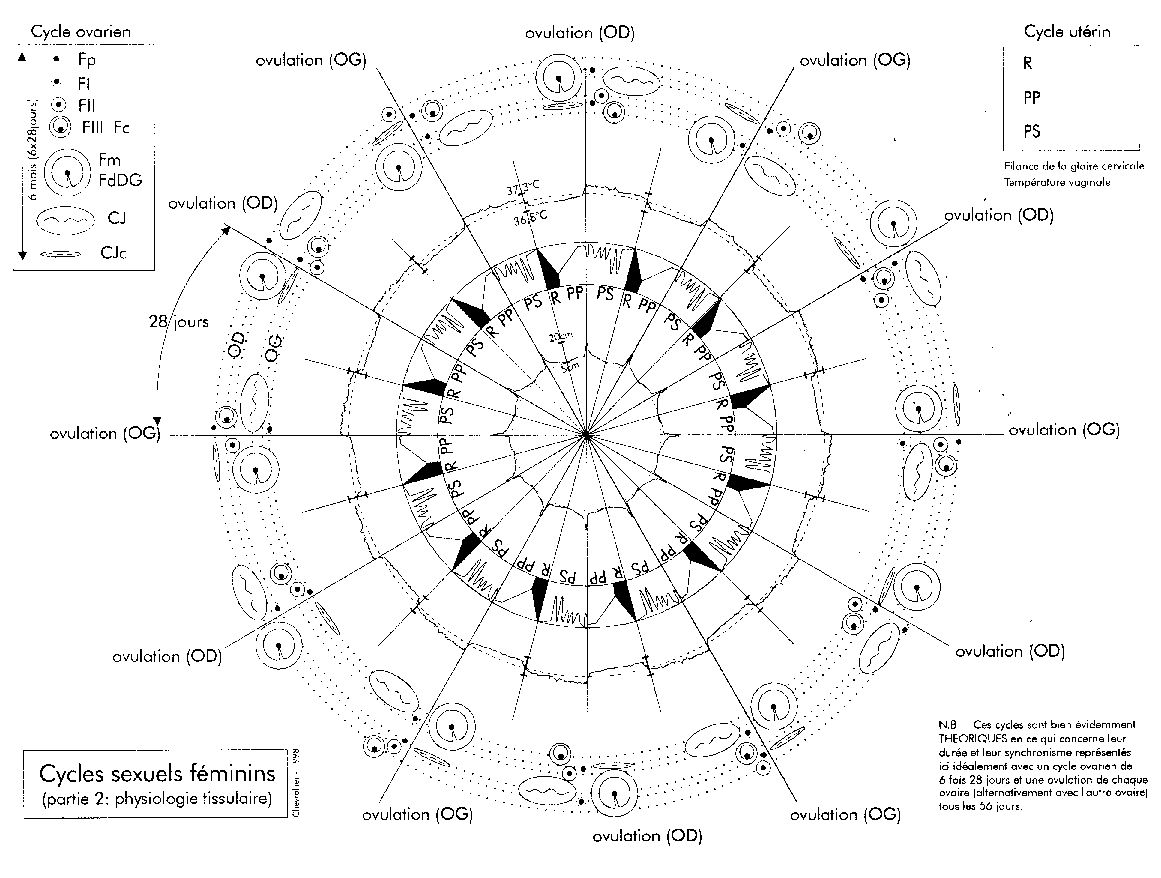
Une représentation des cycles des deux ovaires (droit OD et gauche OG).
Pour le cycle ovarien : Fp = follicule primordial, FI = follicule primaire, FII = follicule secondaire, FIII = follicule tertiaire (ou Fc = follicule cavitaire), Fm = FdFG = follicule mûr ou de De Graaf, CJ = corps jaune, CJc = corps blanc ou corps jaune cicatriciel.
Pour le cycle utérin : R = règles, PP = phase proliférative de la muqueuse utérine, PS = phase sécrétoire de la muqueuse utérine. Ces cycles théoriques sont présentées pour un fonctionnement exactement alternatif des deux ovaires et des cycles utérins réguliers de 28 jours exactement, ainsi que pour un temps de passage Fp à Fm (ovulation) de 5 fois 28 jours.
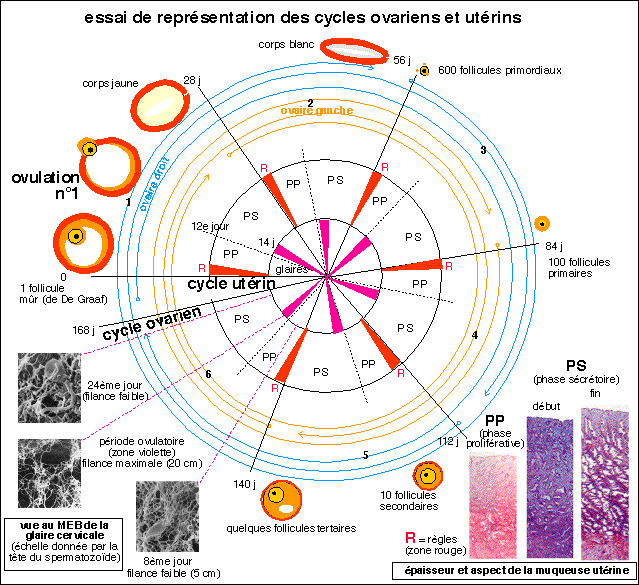
5 mois et demi (168 jours) = UN "cycle" ovarien complet
ou SIX "cycles" ovariens entrecroisés entre l'ovaire droit et l'ovaire gauche
pour SIX cycles utérins complets
Un schéma simplifié qui rompt avec la représentation habituelle source d'erreurs.... (photos d'après Bordas, Tavernier, 1ère AB, 1988)... mais qui est incontestablement encore trop compliqué....Le cycle ovarien dure près de 6 mois pour un groupe de follicules primordiaux mais plusieurs cycles se déroulent en même temps dans chaque ovaire (décalés de 56 jours) et entre les deux ovaires (décalés de 28 jours)...alors que le cycle utérin est bien de 28 jours, de façon théorique.
On fait habituellement commencer le cycle utérin à l'apparition des règles ou menstruations ou encore phase catamériale (chez la femme et seulement quelques espèces de singes) qui correspond à la dégradation de la muqueuse utérine (endomètre) du cycle précédent (4/5ème de la superficie environ) du notamment à la nécrose des artères spiralées qui se développent surtout en fin de phase sécrétoire. Le sang est rendu incoagulable par sécrétion d'un facteur fibrinolytique (la fibrine est une protéine essentielle de la coagulation) local. L'épaisseur de l'endomètre est alors minimale (environ 1 mm). Les saignements des règles s'accompagnent souvent de contractions de la musculeuse utérine (myomètre) plus ou moins douloureuses. Les règles peuvent durer environ 5 jours (3 à 6 jours) puisque la destruction de l'endomètre n'intervient pas d'un seul coup mais par lambeaux ; puis l'endomètre commence à s'épaissir par prolifération des cellules muqueuses (phase proliférative), pour atteindre 5 mm d'épaisseur maximale à ce stade. Pendant toute la durée de la phase proliférative des contractions utérines plus ou moins fortes interviennent. A partir du 13ème jour du cycle sexuel, se fait un "silence utérin" caractérisé par l'arrêt des contractions utérines, la muqueuse se creuse de glandes en doigt de gant qui sécrètent un abondant mucus (glaires) et du glycogène : c'est le début de la phase sécrétoire. L'épaisseur maximale de l'endomètre, atteinte pendant cette phase (phase lutéinique ovarienne), est de 8 mm chez la femme. On notera l'aspect "déchiqueté" de l'endomètre (on parle de dentelle utérine CHEZ LA LAPINE), favorable à la nidation, c'est-à-dire à l'installation, dans une de ces cryptes, de l'embryon issu de la fécondation, qui a lieu au niveau d'une des trompes. Au niveau du col de l'utérus, la muqueuse est réduite et sécrète un mucus clair plus ou moins abondant et filant (glaires cervicales de cervix = le col en latin) qui permettent de déterminer l'étape du cycle sexuel (on mesure la filance, c'est à dire l'étirement sans rupture qui est maximal autour de l'ovulation : plus de 20 cm).
Chez la femme le cycle vaginal reste discret alors qu'il est accompagné de profondes modifications chez de nombreux mammifères. Le frottis vaginal chez la femme permet essentiellement de dépister un éventuel cancer de l'utérus plutôt que de déterminer les étapes du cycle sexuel, même si la période post-ovulatoire est marquée par une augmentation de la kératinisation des cellules et donc du nombre de cellules mortes (mesuré par l'index caryopycnotique).
2.2 Chez le jeune homme
Le système reproducteur masculin comprend :
- des voies génitales, communes (urètre) dans la partie terminale pénienne (externe) avec les voies urinaires, au sein d'un organe copulateur impair, le pénis. Les voies génitales internes se séparent d'avec les voies urinaires au niveau de la prostate et se continuent par deux spermiductes (canaux déférents) aboutissant à l'épididyme coiffant chaque testicule.
L'épididyme est le lieu d'acquisition de la fécondance des spermatozoïdes et de leur aptitude à la mobilité (ils ne seront mobiles qu'après l'éjaculation). Le temps de transit dans l'épididyme est de l'ordre de 10 jours.
Les canaux déférents sont essentiellement un réservoir (d'une contenance supérieure à plusieurs éjaculats) mais ils peuvent éliminer les spermatozoïdes non utilisés par phagocytose ou par élimination dans les urines. Les spermatozoïdes y conservent leur pouvoir fécondant pendant au moins trois semaines. Les canaux déférents sont innervés au niveau de leurs muscles lisses. - les glandes de le gamétogenèse sont les testicules (gonades masculines pairs) situés à l'extérieur de l'organisme dans les bourses. Les glandes annexes sécrétant la majeure partie du liquide séminal (sperme) sont la prostate (deux demi-glandes regroupées en un organe impair), les vésicules séminales, les glandes bulbo-urétrales, et éventuellement l'épididyme qui a à la fois un rôle de stockage et de maturation des spermatozoïdes.
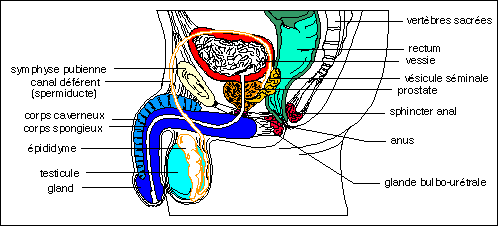
Coupe sagittale de l'appareil génital masculin.
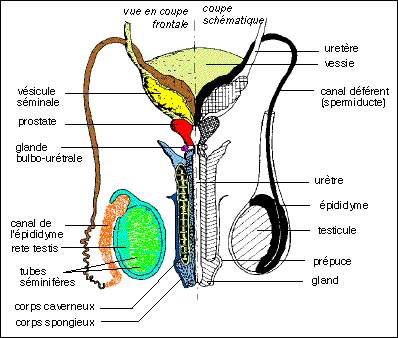
Un schéma inhabituel de l'appareil génital masculin en vue frontale
(d'après Vander in Précis de Physiologie, Doin, 1998) mettant bien en évidence les organes ou conduits pairs ou impairs.
Chez l'homme comme chez de nombreux mammifères, les testicules migrent avant la naissance, depuis une position embryonnaire voisine du rein, vers une position à l'extérieur de l'abdomen, dans des poches cutanées (les sacs scrotaux) qui, avec les fibres élastiques et musculaires lisses du derme (muscle dartos) et les muscles lisses étirés provenant de la cavité abdominale (muscle crémaster du grec kremastêr = suspenseur), forment les bourses. Le maintien du testicule et de l'épididyme à une température inférieure de 4 à 6°C à celle du corps est indispensable chez l'homme pour le bon déroulement de la méiose et la conservation des spermatozoïdes. La cryptorchidie (maintien des testicules en position haute, intra-abdominale) entraîne une stérilité définitive et doit donc être opérée rapidement chez le jeune enfant. Le maintien de la température basse au niveau du testicule résulte de l'arrangement vasculaire (on parle d'échangeur thermique) au niveau du testicule (la contraction du dartos réduit la surface du testicule), de la position du testicule par rapport à l'abdomen (la contraction des cremaster vient placer les testicules contre la paroi abdominale), et d'une régulation circulatoire (si la température scrotale est élevée artificiellement le rythme respiratoire s'accélère).
|
Les testicules présentent principalement deux fonctions : |
3. au niveau des cellules
3.1 Chez la jeune femme
Du point de vue des cellules sexuelles, les cellules primordiales germinales d'origine endodermique, appelées gonocytes se divisent activement par mitose entre le 3ème et le 5ème mois après la fécondation et donnent naissance aux ovogonies (groupées par paquets et reliées par des ponts cytoplasmiques). Commence alors une phase d'accroissement pendant laquelle les ovogonies se séparent, s'entourent de quelques cellules folliculaires aplaties, se chargent de réserves, augmentent de diamètre jusqu'à atteindre environ 50 µm, et présentent un certain nombre de modifications au niveau du noyau car les chromosomes deviennent visibles (condensation de l'ADN). Certaines ovogonies sont clairement au stade leptotène de la prophase méiotique, on dit qu'ils sont entrés en méiose. On observe de tels stades chez la femme à partir de la 7ème semaine de vie fœtale jusqu'à la naissance, soit environ 20 jours après le début de différenciation sexuelle de l'ovaire en gonade féminine. Puis les chromosomes (qui sont arrivés au stade diplotène) se décondensent. On note que cette maturation se fait toujours avec un pic d'oestradiol chez tous les Mammifères étudiés, mais aussi chez des Reptiles et des Oiseaux. Ces gonocytes sont alors devenus des ovocytes I (il faut veiller à conserver le terme d'ovocyte primaire, souvent masqué par le chiffre I que l'on énonce "un" parfois un peu rapidement; le terme d'ovocyte secondaire faisant référence à un ovocyte qui est issu d'une division de l'ovocyte primaire et qui est présent chez l'homme mais pas chez tous les animaux, bien évidemment) dont le stock est donc déterminé à la naissance. On estime à près de 7 millions le nombre de gonocytes qui donneront environ 1 à 2 millions d'ovocytes I à la naissance, et on pense qu'il ne reste plus qu'environ 300.000 ovocytes I dans les deux ovaires à l'âge de 7 ans (au moment de la puberté), tous les autres ovocytes ayant dégénéré. On pense qu'après les quelques 300 ovulations d'une femme au cours de sa vie sexuelle (entre la puberté et la ménopause), il y a épuisement du stock d'ovocytes, ce qui fait quelques 600 à 1000 ovocytes I au total impliqués dans chaque phénomène de maturation conduisant à l'ovulation. On considère que l'arrêt du fonctionnement ovarien coïncide avec l'épuisement du stock d'ovocytes (la femme a un épuisement très précoce par rapport à d'autres Mammifères pour lesquels celui-ci arrive en fin de vie). Du point de vue du stade méiotique, on dit souvent que l'ovocyte I semble a commencé la première division de méiose, mais en fait l'ovocyte I n'est pas bloqué en prophase de 1ère division mais à un stade de décondensation qui fait suite à une maturation sexuelle et qui est similaire au stade G2 (interphase, après duplication de l'ADN) mais avec un début de condensation de l'ADN (source : Biologie moléculaire de la cellule, 3ème éd., p 1020). Dans ce cas la méiose de commencerait que quelques jours ou quelques dizaines d'heures avant l'ovulation (actuellement on parle de déblocage de la méiose ou reprise de la méiose, 12 h avant l'ovulation...). Les phénomènes cellulaires qui interviennent lors des étapes qui se déroulent pendant la longue phase de repos et de dégénérescence (on parle d'atrésie (du grec a : privatif et trêsis : perforation) folliculaire : disparition des cellules folliculaires et de l'ovocyte sans ovulation) ont des déterminismes encore mal connus (1 ovocyte I sur 20 en "réchappe"... et 1 ovocyte présent à la naissance sera ovulé sur 7.000 ). Les mécanismes cellulaires de l'atrésie restent très discutés. Ils sont rapprochés de l'apoptose (du grec apo : loin et piptein : tomber), mécanisme de dégradation enzymatique de l'ADN, car des cellules de follicules atrésiques présentent une transformation du noyau en une masse compacte de chromatine (cellule dite pycnotique, du grec puknos : compact). De nombreux facteurs chimiques ont été invoqués ainsi que la vascularisation du follicule.
Un prolongement : ne pas oublier que le concept de méïose n'est .....qu'un concept :
Si l'on part de considérations cytologiques et si l'on se réfère aux mécanisme connus sans s'intéresser à la structure des chromosomes, on peut proposer une interprétation des mécanismes reproducteurs avec un seul type de division cellulaire: la mitose.
Je m'explique:
Que se passe-t-il donc de différent dans les cellules sexuelles ? D'une part il y a une période de maturation sexuelle qui est plus ou moins longue mais qui précède la "mitose sexuelle". Classiquement on place ces phases dans la prophase de la première division de méiose. On distingue 5 stades inégaux ou non selon l'aspect des chromosomes qui sont alors visibles (leptotène, zygotène, pachytène, diplotène et diacinèse). Cette période de maturation est toujours longue par rapport aux divisions qui lui font suite (plus de 11 jours sur 12 en comptant les deux divisions aboutissant à la formation des spermatozoïdes chez la souris, 6 jours sur 7 pour la formation des grains de pollen chez le lis, plus de 10 ans si l'on considère l'ovocyte féminin, et plus de 20 jours sur 21 pour les spermatozoïdes humains).
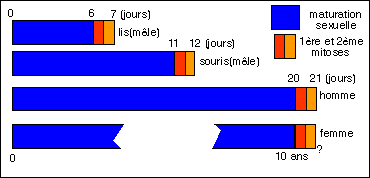
Comparaison entre les temps de maturation de la cellule sexuelle et la durée des deux divisions (appelées mitoses ici)
qui lui succèdent chez quelques organismes.
C'est pendant cette longue période que l'on place l'hypothétique crossing-over (voir à ce sujet le cours de terminale). Si l'on se réfère à ce qui se passe lors de la division qui suit cette période de maturation sexuelle, il y a toujours séparation des chromosomes homologues et non des chromatides... pourquoi ne pas alors invoquer les fameux complexes synaptonémaux et les chiasma qui en résultent (?) pour justifier que dans la mitose qui lui fait suite, les chromatides de chaque chromosome restent aisément accolées alors que les chromosomes homologues sont tirés chacun d'un côté de la cellule ou de l'autre. La mitose qui fait suite à une maturation sexuelle, que l'on peut qualifier de mitose sexuelle sépare donc les homologues et non les chromatides de chaque chromosome. Si les cellules filles en restent là et ne se divisent plus on a des cellules à n chromosomes mais avec une quantité d'ADN identique à celle de la cellule de départ (classiquement notée Q). Un argument important dans cette interprétation est que lors de cette division il n'y a pas de division des centrioles, comme pour toutes les mitoses des plantes. Ce phénomène est aussi retrouvé dans les activations parthénogénétiques des ovocytes de mammifères qui se divisent sans centriole, même si les centrioles semblent se former de novo, après plusieurs divisions de segmentation (source: La reproduction des vertébrés, Masson, 1998, p 190).
La division suivante peut donc se faire directement sans passer par une interphase avec notamment une phase S de synthèse. Une des clés de la division cellulaire est sans aucun doute dans la formation et la duplication des centrosomes (voir paragraphe précédent). On sait provoquer chez l'oursin des bourgeonnements de la cellule qui contiennent des centrosomes mais pas de noyau (Biologie moléculaire de la cellule, 3ème éd., p 914). La mitose intervenant à la suite de la mitose sexuelle et non précédée par une interphase pourrait donc séparer les chromatides de chaque chromosomes pour obtenir ainsi des cellules haploïdes avec une quantité d'ADN de Q/2.
Cette interprétation de la maturation sexuelle des cellules dites "germinales" et des éventuelles mitoses qui suivent remet aussi en cause la notion de lignée germinale et somatique qu'il serait tout aussi intéressant de bousculer un peu.
Lors de la folliculogénèse, on pourra noter que les cellules de la granulosa forment une population homogène, reliées par des jonctions perméables (gap-junctions). La granulosa est séparée de la thèque interne par une lame basale (composée essentiellement de fibronectine) que ne pénètrent ni les capillaires sanguins, ni les fibres nerveuses. (Cette disposition est à rapprocher de la structure du testicule avec les cellules de Sertoli et germinales d'un côté et les cellules de Leydig de l'autre de la lame basale..). A maturité, un follicule féminin mesure 15 à 20 mm et contient près de 5 millions de cellules folliculaires.
On en arrive en effet au problème central en biologie de la formation de l'œuf (car c'est bien lui qui va déterminer le développement embryonnaire).
Durant l'ovogenèse, la phase de maturation de l'œuf qui comprend la maturation sexuelle au sens employé ci-dessus, ne présuppose pas des éventuelles divisions qui lui font suite. On observe en effet que l'œuf (mature donc libéré par la gonade) peut être, selon les groupes animaux, à différents stades de division et donc, vis-à-vis de son matériel génétique, peut être diploïde (la quantité d'ADN est de 2Q par rapport à la quantité d'ADN d'une ovogonie et le nombre de chromosomes est de 2n (l'étoile de mer ou l'Ascaris par exemple), l'œuf peut aussi être bloqué en métaphase chromosomique d'une première division (Insectes ou Prochordés)) ou haploïde (à la suite d'une déroulement complet d'une division, la plupart du temps très inégale donnant un globule polaire et un ovocyte secondaire qui possède n chromosomes avec une quantité d'ADN Q) avec début d'une nouvelle division (et blocage en métaphase "chromosomique" comme les Vertébrés) ou déroulement complet comme l'oursin (n chromosomes avec Q/2 d'ADN).
Le deuxième point important concerne les caractéristiques cytologiques de la cellule œuf (désormais au sens de cellule sexuelle femelle mature). Sa taille (en fait son volume) tout d'abord et ses réserves qui sont liées à ce paramètre. Un cellule embryonnaire typique humaine a un diamètre d'une dizaine de micromètres alors que la cellule œuf en mesure typiquement 120 (le rapport entre le volume de ces deux cellules supposées sphériques est de 1/1000 car je n'ose rappeler que le volume augmente avec le cube du rayon de la sphère). On a un rapport assez équivalent pour l'œuf d'oursin (Echinodermes) ou de Cnidaire. Une cellule embryonnaire d'amphibien ne semble pas être fondamentalement de taille différente à celle d'un embryon humain et donc voisine d'une à quelques dizaines de micromètres alors que la cellule œuf d'amphibien atteint de un à quelques millimètres (ce qui fait un rapport de volume de l'ordre de 1/8000). On a un rapport voisin pour les Annélides, les Mollusques Lamellibranches, les Agnathes.... Les œufs de très grande taille (oiseaux, reptiles, Céphalopodes, Sélaciens, Monotrèmes...) atteignent quelques centimètres pour une cellule embryonnaire de quelques centaines de micromètres tout au plus, ce qui fait un rapport volumique de plus de 1/ 1.000.000 (quoique l'on s'éloigne de plus en plus du modèle sphérique). Pour les arthropodes (dont les insectes), l'œuf, franchement allongé et atteignant quelques millimètres, semble présenter un rapport voisin de celui des amphibiens. Cet accroissement volumique peut être relié directement à la quantité de réserves. Les catégories cités plus haut correspondent aux classiques œufs alécithes, oligolécithes, hétérolécithes, télolécithes et centrolécithes qui font aussi référence à la position du noyau de l'œuf dans la cellule géante. Ces catégories, très perfectibles, sont essentielles pour comprendre les premières étapes du développement embryonnaire. On citera par exemple les cocons des Plathelminthes qui contiennent une œuf entouré de cellules vitellines complètes... et qui ne rentrent pas dans ce cadre trop étroit.
On en arrive donc aux phénomènes chromosomiques qui se déroulent lors de l'ovogenèse. Si l'on considère l'augmentation de volume de la cellule, il semble indubitable qu'il doit y avoir une expression extrêmement performante de l'information génétique (partiellement bien sûr) au cours de cette période, ne serait-ce que pour synthétiser les innombrables réserves. On doit bien sûr prendre en compte l'apport extracellulaire (la synthèse du vitellus est classiquement localisée au foie chez les oiseaux par exemple, puis celui-ci passe dans le sang pour gagner les ovaires). Il ne faut pas non plus négliger le rôle des cellules folliculaires ou d'autres cellules qui peuvent avoir un rôle nourricier pour l'œuf en cours de croissance. Mais on explique aisément par cet énorme besoin de synthèse les fréquentes polyploïdies observées. Il est aussi connu (Biologie moléculaire de la cellule, 3ème éd., p 1024) que le nombres des gènes codant pour des ARN ribosomiaux augmente fortement (jusqu'à plusieurs millions de copies de ces gènes pour les amphibiens par exemple alors qu'une cellule embryonnaire typique n'en contient que quelques centaines). On notera aussi l'interprétation que l'on fait des chromosomes en écouvillon de nombreux ovocytes en cours de maturation, les boucles d'ADN déroulé correspondant peut-être à des sites en cours de transcription.
En résumé, chez la femme le gamète femelle ou cellule œuf, est un ovocyte secondaire (ovocyte II) (bloqué en métaphase de deuxième division de méiose, accolé à un globule polaire (GP1), entouré d'une membrane pellucide et de nombreuses cellules folliculaires (formant le cumulus oophorus).
3.2 Chez le jeune homme
Les testicules humains peuvent être décrits comme comprenant deux compartiments séparés par une membrane basale (voir schéma dans la partie suivante) et entourés par une tunique fibreuse (l'albuginée) formée de cellules conjonctives et de cellules musculaires lisses, l'ensemble étant richement irrigué:
- un compartiment interne ou germinal : avec deux types de cellules : les cellules de Sertoli (cellules somatiques, c'est-à-dire non transmises lors de la reproduction : elles appartiennent au soma) et les cellules germinales (on dit aussi cellules de la lignée germinale : spermatogonies, spermatocytes, spermatides et spermatozoïdes) qui subissent notamment la méiose mais aussi de nombreuses mitoses et qui sont entourées par les cellules de Sertoli.
A partir de la puberté les cellules de Sertoli ne se multiplient plus, elles se fixent à la membrane basale et établissent des liaisons entre elles en formant une barrière (barrière hémato-testiculaire) imperméable aux hormones peptidiques, aux lipoprotéines et aux grosses molécules en général.
Les cellules germinales primordiales se multiplient dans les crêtes génitales chez l'embryon (voir embryologie plus haut) puis dans le compartiment germinal entre les cellules de Sertoli jusqu'à la puberté en formant des spermatogonies souches qui se diviseront régulièrement à partir de la puberté pour donner naissance aux lignées spermatogénétiques successives. Contrairement à l'ovaire il n'y a pas de début de méiose avant la puberté (cette quiescence semble du à un facteur inhibiteur sécrété par les cellules de Sertoli MPF(meiotic preventing factor) : en effet des spermatogonies souche déplacées hors du contrôle des cellules de Sertoli, entrent en méiose). Les spermatogonies qui se divisent restent souvent reliées par des ponts cytoplasmiques et forment ainsi des clones dont les mitoses sont synchronisées. Comme pour l'ovaire on observe (sans explication) un grand nombre de dégénérescences par apoptose des spermatogonies souches. Le terme cycle spermatogénétique désignant les transformations d'une spermatogonie à un ensemble de spermatozoïdes (multiplication, méiose, spermiogenèse), est certes mal choisi car il n'y a pas de retour au point de départ (le terme d'hélice spermatogenétique serait bien plus approprié : ce sont en effet des hélices où les cellules de la lignée germinale présentent une série de transformations successives qui s'imbriquent le long du tube séminifère) mais est employé. Le nombre théorique de spermatozoïdes obtenus par division mitotiques puis méiose d'une spermatogonie souche (souvent 3 mitoses goniales suivies d'une méiose et donc (1x2=>2x2=>4x2=>8x4=>) 32 spermatozoïdes) est... théorique. Le nombre de divisions goniales est régulé par d'innombrables facteurs endocrines et paracrines (des cellules de Sertoli notamment amis aussi des cellules germinales en cours de spermatogenèse qui exercent un rétrocontrôle sur les mitoses goniales...). De nombreuses dégénérescences par apoptose interviennent aussi. La phase de spermiogenèse, élaboration d'une vésicule contenant de nombreuses enzymes (acrosome) et perte de la majeure partie du cytoplasme dans lequel il reste un appareil mitochondrial important placé en hélice autour du centriole essentiel pour la fécondation et prolongé par le flagelle, structure locomotrice, compaction de l'ADN avec élongation et compaction nucléaire, production et mise en place de protéines membranaires et cytoplasmiques nécessaires à la fécondation (notamment d'un facteur d'activation de l'ovocyte). Ces modifications nécessitent la transcription et la traduction de l'information génétique. Ces mécanismes sont relativement synchronisés entre les spermatides issus d'une même gonie, du fait des ponts cytoplasmiques et de la continuité de la membrane cellulaire du moins dans les premières étapes de la spermiogenèse. La durée de l'hélice spermatogénétique est d'environ 74 jours pour l'homme (ce temps correspond approximativement aux 24h de durée d'une mitose goniale suivie de la durée mesurée très précisément à l'aide de marqueurs radioactifs et strictement constante pour chaque espèce entre le début de formation des spermatocytes I (stade leptotène) et l'obtention des spermatozoïdes, la méiose durant elle aussi environ 24h).
Des cellules myoïdes (musculaires lisses mais peu différenciées) doublent la lame basale sur sa partie externe. Elles ne semblent pas innervées et se contractent sous l'action de médiateurs circulants. Elles participent à l'expulsion mécanique des spermatozoïdes du testicule. - un compartiment externe ou interstitiel composé uniquement de cellules somatiques, cellules conjonctives, cellules des systèmes sanguins et lymphatiques et cellules à fonction endocrine (cellules de Leydig ou encore appelées de façon trop imprécise les cellules interstitielles). Ce compartiment est innervé. Les cellules de Leydig proviennent du même amas de cellules embryonnaires que les cellules de Sertoli. Elles ne se multiplient que pendant la période embryonnaire et commencent immédiatement à sécréter des stéroïdes intervenant dans la différenciation sexuelle des voies et des organes génitaux masculins. Puis elles régressent jusqu'à la puberté à partir de laquelle elle présentent chez l'homme une activité endocrine cyclique quasi continue jusqu'à la mort.
4. au niveau des molécules : le complexe hypophyse-gonades
Chez la jeune femme
Il semblerait que chez la jeune fille impubère, les concentrations en hormones hypophysaires de type gonadostimulines (LH et FSH) soient très faibles et constantes, les concentrations en hormones ovariennes (oestradiol, oestrone...) extrêmement faibles, tout comme la sécrétions endocrines hypothalamiques de gonadolibérines (GnRH). La mise en place de la fonction endocrine sexuelle hypothalamique (et donc du système nerveux) semble être le facteur déclenchant de la mise en place des cycles sexuels féminins.
Le fonctionnement cyclique de l'ovaire est la première donnée. Conjointement aux modifications histologiques et cytologiques que nous avons vu précédemment, la fonction endocrine de l'ovaire est elle aussi cyclique. La phase folliculaire s'accompagne d'une sécrétion croissante d'œstrogènes (par les cellules de la thèque interne et les cellules folliculaires) et la phase lutéinique d'une sécrétion de progestérone (par les cellules lutéales), alors que la sécrétion d'œstrogènes est maintenue de façon plus ou moins importante. En cas de fécondation, le développement très important du corps jaune gestatif est à l'origine d'une sécrétion de progestérone beaucoup plus importante. Les sécrétions sont ensuite relayées par le placenta, une fois celui-ci en place.
Le contrôle du fonctionnement cyclique est réalisé par l'antehypophyse. Si le rôle de la FSH, hormone antéhypophysaire, semble dominer pendant la phase folliculaire, elle est aussi nécessaire en phase lutéinique. De même la LH, présente aussi en phase folliculaire, semble jouer un rôle fondamental dans l'ovulation (pic ovulant) et dans la lutéinisation (formation du corps jaune et sécrétion de progestérone par celui-ci). Une liaison directe nerveuse pour l'ovulation existe aussi certainement. Etant donné les faibles taux sanguins de ces hormones hypophysaires on est loin de pouvoir suivre aisément les variations de leur sécrétion en fonction de tous les paramètres supposés efficaces. On pense actuellement que ces deux hormones sont sécrétées alternativement par les mêmes cellules...
Chez le jeune homme
A partir d'environ onze ans (puberté), des cellules de Leydig de nouveau en activité sont décelables dans le tissu interstitiel. Leur sécrétion d'androgènes (testostérone) est sous la dépendance des hormones hypophysaires LH (nommée aussi ICSH chez l'homme : intersticial cells stimulating hormone) et FSH , elles-mêmes commandées par l'unique hormone hypothalamique la GnRH, comme chez la femme. La sécrétion de GnRH chez l'homme adulte est rythmique (un pic toutes les 90 minutes). L'administration continue de GnRH provoque une désensibilisation de ses récepteurs et on observe alors une castration chimique. La testostérone agit en retour (feed-back négatif) sur la sécrétion des hormones hypophysaires, indirectement en agissant sur l'hypothalamus (la testostérone diminue la fréquence des pics de GnRH) et directement sur l'hypophyse (la testostérone inhibe la sécrétion de LH). La testostérone agit sur les cellules de Sertoli notamment par l'intermédiaire d'une protéine de liaison des androgènes elle-même sécrétée par les cellules de Sertoli sous l'action de la FSH. Les cellules de Sertoli sécrètent aussi l'inhibine, une hormone inhibant la sécrétion de FSH par l'hypophyse. La testostérone, hormone masculinisante intervient sur l'ensemble de l'appareil génital et est responsable du maintien des caractères sexuels secondaires (pilosité, croissance, répartition des masses graisseuses et musculaires, timbre de la voix, sécrétions des glandes sébacées, développement des muscles squelettiques...).
Des précisions (issus de Reproduction des vertébrés, Masson, 1998) un essai de présentation globale:
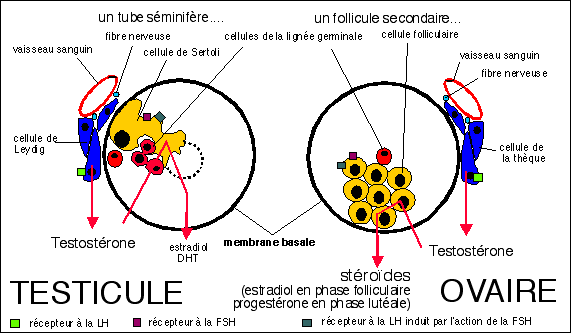
Une comparaison vraiment intéressante...
à gauche un tube séminifère, à droite un follicule secondaire TRÈS SCHÉMATISES...
(voir le texte ci-dessous pour des explications plus détaillées)
Le développement ovarien et testiculaire, du moins à partir d'un certain stade de croissance, est sous le contrôle absolu des gonadotropines (FSH et LH).
Les cellules de la thèque interne ont des récepteurs à la LH (dès la formation de l'antrum) mais pas de récepteurs à la FSH.
Par contre les cellules de la granulosa expriment très tôt des récepteurs à la FSH, cette dernière induisant l'expression de récepteurs à la LH.
De la même façon, les cellules de Leydig ont des récepteurs à la LH mais pas les cellules de Sertoli, uniquement sensibles à la FSH.
L'oestradiol (orthographié aussi estradiol) est produit essentiellement par les cellules de la granulosa qui transforment (activité aromatase) la testostérone en estradiol, sous l'action stimulante de la FSH. C'est la thèque interne, sous l'action de la LH, qui sécrète de la testostérone.
La FSH intervient aussi en stimulant la sécrétion d'inhibine par les cellules de la granulosa ; l'inhibine, à son tour stimule la sécrétion de testostérone par les cellules de la thèque).
Chez l'homme, ce sont aussi les cellules de Sertoli qui sécrètent l'inhibine sous l'action de la testostérone (potentialisée par les protéines liant les androgènes sécrétées par les cellules de Sertoli sous l'action de la FSH).
Il y a donc clairement une analogie entre
- les cellules externes: cellules Leydig (sensibles à la LH) sécrétant la testostérone et cellules des thèques internes (sensibles à la LH) sécrétant aussi la testostérone
- les cellules internes : cellules de Sertoli (sensibles à la FSH) sécrétant l'inhibine et contrôlant la spermatogenèse essentiellement sous l'action de la testostérone, et les cellules de la granulosa (sensibles d'abord à la FSH) contrôlant l'ovogenèse et sécrétant des stéroïdes en transformant la testostérone.
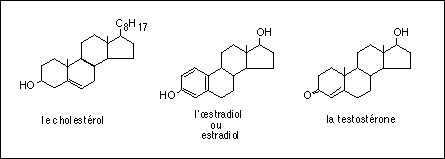
Remarque : les hormones stéroïdes sont dérivées du cholestérol et sont synthétisées par les cellules qualifiées de stéroïdogènes notamment grâce à leur équipement en récepteur au cholestérol circulant (sous forme de lipoprotéines) et d'enzymes assurant la synthèse mitochondriale des stéroïdes (les chaînes de synthèse fonctionnent notamment grâce à des cytochromes spécifiques). Les gonadotropines stimulent à la fois la synthèse des stéroïdes et des cytochromes. Progestérone, testostérone et estradiol ont des récepteurs nucléaires spécifiques (activant directement certains gènes...) dans de nombreux neurones, cellules hypophysaires, des voies génitales et du foie. Mais les stéroïdes agissent aussi à des niveaux non génomiques (estradiol par exemple sur les récepteurs du GABA ou les récepteurs des opiacés...).D'une façon très générale les stéroïdes agissent sur la multiplication des cellules, leur différenciation fonctionnelle et leurs activités de synthèse.
Sous l'action des gonadotropines (LH et FSH) les follicules sécrètent de nombreuses protéines dont certaines ont des actions autocrines (stimulation de la cellule sécrétrice elle-même), d'autres paracrines (stimulation des cellules voisines sans transport par le sang), d'autres enfin endocrines (sécrétion d'hormones), notamment ceux agissant sur la sécrétion des gonadotropines par l'antehypophyse. On peut citer les facteurs de croissance de la famille des TGF-ß (activines-inhibines, follistatine), les facteurs de la famille des IGFs (Insuline-like-Growth Factor), les facteurs de la famille des EGFs (Epidermal Growth Factor).
Le blocage de la méiose persiste tant que l'ovocyte n'a pas accumulé de réserves (80% de sa taille finale chez les Mammifères). Alors, si l'ovocyte est cultivé isolément, il reprend spontanément sa méiose. On a donc recherche un facteur d'inhibition, qui reste inconnu à ce jour. Certains auteurs pensent donc qu'il n'existe pas. La séparation de l'ovocyte d'avec ses cellules folliculaires (qui sont très étroitement liées à l'ovocyte car des "pieds " pénètrent la partie périphérique du cytoplasme, isolée bien sûr par la membrane plasmique), fait intervenir dans tous les cas de profonds remaniements cytologiques. La reprise de méiose est toujours marquée par un pic de Ca2+, comme la fécondation.
On a mis aussi en évidence un facteur de nature chimique encore inconnu qui semble être indispensable à la décondensation du noyau du spermatozoïde qui a fécondé l'ovocyte. Ce facteur (MPGF = male pronucleus growth factor) est sécrété par les cellules de la granulosa, est diffusible et est accumulé dans le cytoplasme de l'ovocyte....
L'ovulation semble être d'abord sous contrôle d'une élévation du niveau plasmatique d'estradiol (pour les Mammifères) qui provoque la décharge de GnRH responsable de la décharge des gonadotropines hypophysaires.
Il semble que ce soit la quantité de gonadotropines disponibles par rapport au besoin des follicules en croissance qui détermine pour une espèce son taux d'ovulation.
Des techniques de perfusion d'ovaires mûrs de Mammifères in vitro ont permis de préciser les déterminismes de l'ovulation : la première étape est la dissociation des cellules folliculaires essentiellement sous l'action de la FSH qui provoque une sécrétion d'acide hyaluronique par les cellules de la granulosa, libérant ainsi l'ovocyte dans l'antrum. Le gonflement du follicule est rendu possible par la dissociation des fibres de collagène des membranes externes de l'ovaire (albuginée) et de la thèque externe. La rupture du follicule semble résulter non d'une augmentation de la pression dans la cavité folliculaire mais d'un amincissement et d'une dissociation des cellules de la paroi du follicule au niveau de l'apex, zone protubérante du follicule mûr. Quelques heures avant l'ovulation on observe une vasoconstriction générale de l'ovaire qui provoque la mort des cellules épithéliales au niveau de l'apex. C'est la dégradation des cellules épithéliales (enzymes lytiques libérées...) qui provoquerait la rupture de l'albuginée et des thèques sous-jacentes. On observe alors une fuite de liquide folliculaire qui fait baisser la pression hydrostatique du follicule et c'est cette dernière qui provoquerait l'expulsion complète de l'ovocyte et des cellules périovocytaires (formant la corona radiata) par une contraction de l'ovaire. L'ovulation est actuellement considérée comme un mécanisme relevant de la réaction inflammatoire localisée. En effet, on y retrouve tous les facteurs chimiques (histamine, prostaglandines, bradykinine...) entraînant une augmentation du flux sanguin (le volume de sang de l'ovaire est multiplié par sept après la décharge ovulante chez la ratte), une augmentation de la perméabilité vasculaire, arrivée de nombreux phagocytes.... Cette compréhension est évidemment à la base des connaissances sur les mécanismes de régulation artificielle par l'homme des ovulations...
On peut qualifier le corps jaune de glande endocrine éphémère, plus ou moins structurée (l'expression est tirée du Reproduction des vertébrés, p 120, références citées en début de page). Chez les Primates le corps jaune a pour fonction essentielle de synthétiser des hormones stéroïdes, essentiellement la progestérone, mais aussi de nombreuses hormones ou facteurs de croissance peptidiques (ocytocine, relaxine, IGFs, inhibines, prostaglandines...). Le corps jaune inhibe aussi la folliculogénèse. Le développement du corps jaune n'est pas du à une multiplication cellulaire mais à l'hypertrophie des cellules de la granulosa dont le contenu en ADN augmente et qui deviennent polyploïdes. Les cellules de la thèque interne (chez la femme et le singe rhésus) restent groupées en îlots ou en travées associées à du tissu conjonctif et forment des septa entre les amas de cellules lutéales. C'est la LH qui semble contrôler le maintien du corps jaune chez la femme. La régression intervient en absence de fécondation au bout d'environ 2 semaines. On a isolé un facteur de régression du corps jaune : facteur de lutéolyse (du groupe des prostaglandines) chez la brebis. Toutes les expériences tentant de démontrer le rôle des hormones lutéotropes (LH) sur la lutéolyse se sont soldées par des échecs et l'on pense maintenant que celle-ci est bien sous la dépendance d'un facteur sécrété par l'utérus, sauf chez la femme et les Primates, chez lesquels l'hystérectomie (ablation de l'utérus) est sans effet. La question est donc encore ouverte. Des facteurs embryonnaires bloquant la lutéolyse en cas de gestation ont été isolés chez des Primates : le plus connu est l'hCG (human chorionic gonadotropin), sécrété par le trophoblaste (partie la plus externe de l'embryon en cours de développement qui participera notamment à la formation du placenta). Il est sécrété en grande quantité pendant les deux premiers mois de vie embryonnaire, il inhibe la lutéolyse, stimule les sécrétions stéroïdiennes (progestérone surtout) du corps jaune gestatif et du placenta et stimule l'hypertrophie et la relaxation des cellules musculaires du myomètre utérin et des vaisseaux. Le corps jaune persiste chez les Primates pendant toute la durée de la gestation.
En résumé :
Le point de vue fondamental : chez tous les vertébrés la régulation du fonctionnement des gonades (ovaires et testicules) par le système nerveux central se fait par l'intermédiaire d'une glande endocrine interposée entre la gonade et le SNC : l'hypophyse. Cette régulation se fait bien sûr en synergie avec la fonction endocrine propre des gonades qui intervient sur leur propre développement et sur les autres organes de la reproduction. Ce qui peut être illustré par ce petit schéma :
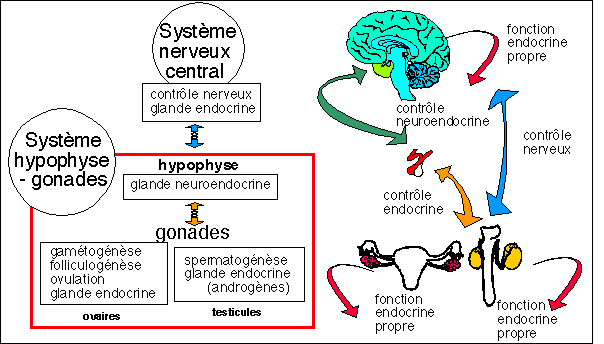
Les relations entre le SNC et les gonades : un glande s'interpose : l'hypophyse...
on peut donc considérer le système hypophyse-gonades comme un tout...
Tous les mécanismes intervenant dans la mise en place de la fonction gonadique comme dans sa modulation en fonction de paramètres environnementaux ou internes semblent aboutir en fin de compte à une accélération / ralentissement de la fréquenceou à une augmentation / diminution de l'amplitude de la libération hypophysaire des hormones gonadotropes.
b. la régulation adaptative - la réponse adaptative des gonades au milieu
(travail social de reproduction des gonades)
Le contrôle du système hypophyse-ovaires fait intervenir une sécrétion pulsatile
